FDA认证冲击中企
记者:王静
发稿日期:2025年12月25日
华盛顿2025年12月25日电 —— 美国食品药品监督管理局(FDA)近期持续强化对海外生产设施的“无通知检查” 与上市后安全数据审查,导致多款中国制造的医疗器械与食品补充剂在美准入周期延长、合规成本激增。业内数据显示,2025年第三季度,中国药企提交的ANDA(仿制药申请) 因工厂cGMP不符合项而收到的完整回应函(CRL)数量环比上升15%。监管铁腕之下,中国企业正面临从“申请准入”到“持续合规”的战略转型阵痛。
“FDA的大门始终敞开,但门槛正在隐形升高。” 前FDA评审官员、现任某国际法规事务咨询公司高级副总裁的迈克尔·陈博士在近期一场线上研讨会上指出。他强调,当前监管焦点已从“文件是否齐全”转向“数据是否真实可靠”以及“生产体系是否具备持续保证质量的能力”。
一、案例剖析:一封完整回应函背后的体系缺失
江苏一家医用敷料生产商在2025年为其主打产品申请510(k)时遭遇挫败。尽管产品测试数据完美,但FDA在对其中国工厂进行远程记录审查时发现,关键生产设备的清洁验证数据存在逻辑断层,且变更控制程序未被严格执行。
“我们收到了CRL,意味着数百万元的研发与测试投入面临风险,必须投入更多资金和时间进行体系整改,并等待FDA重新审查。”该公司国际注册总监刘女士透露。此案例并非孤例,它清晰地表明,仅聚焦于产品测试而忽视质量体系整体合规,已成为中企在FDA受挫的首要原因。
为明晰不同类型产品面临的迥异监管路径与核心挑战,下表进行了关键对比:
表1:FDA主要产品类别监管路径与核心难点分析
| 产品类别 | 核心监管路径 | 2025年监管聚焦点 | 中国企业常见短板 |
|---|---|---|---|
| 医疗器械 | 510(k), PMA, De Novo | 生产一致性:QSR 820体系现场/远程检查;网络安全:对含软件器械的要求。 | 设计历史文件不完整;供应商控制薄弱;无法应对“无通知检查”。 |
| 药品(仿制药) | ANDA | 生物等效性数据真实性;原料药与制剂工厂的cGMP合规性。 | 临床研究数据管理不规范;工厂硬件与文件体系无法持续符合cGMP。 |
| 食品/膳食补充剂 | 企业注册、FSMA合规 | 供应链安全:预防性控制措施;标签声称的合规性。 | FSMA要求的食品安全计划流于形式;未能对海外原料供应商进行有效审计。 |
| 化妆品(新规后) | 强制工厂注册与产品列名 | 安全证明:需有充分数据支持产品安全性;不良反应报告。 | 对2023年生效的《MoCRA》法案准备不足,缺乏专业安全评估。 |
二、决策流程图:从产品定义到准入成功的路径选择
面对复杂的FDA监管网络,企业首先需要像导航一样选择正确的路径。下图系统展示了从产品概念到最终获批的关键决策流程:
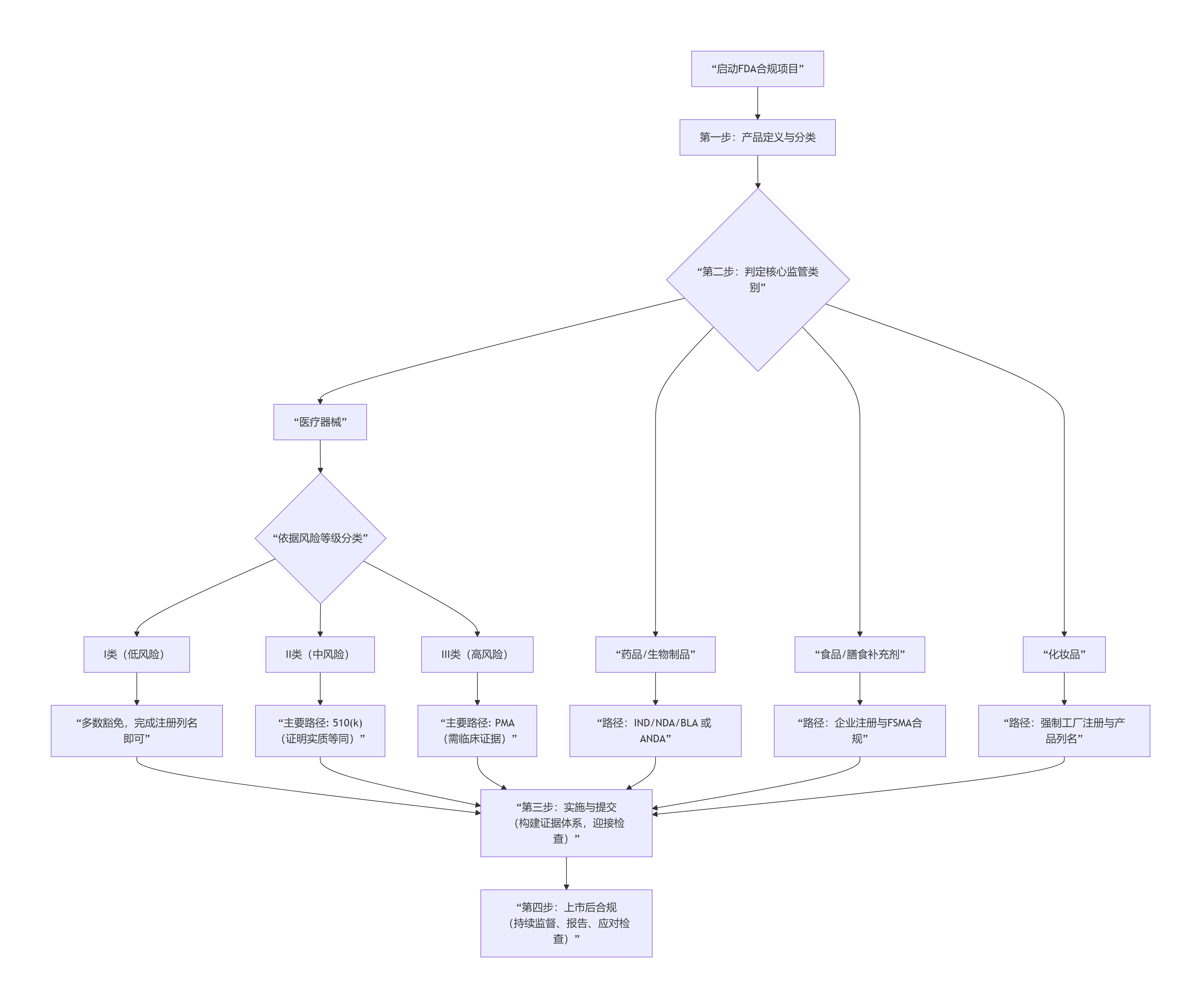 流程图揭示,无论哪条路径,最终的
流程图揭示,无论哪条路径,最终的
三、成本解构:看得见的费用与看不见的风险
FDA合规是一项长期投资,其成本远超官方申请费。企业必须为技术细节和潜在风险预留充足预算。
表2:FDA合规主要成本构成与风险预算(2025年参考)
| 费用大项 | 常见范围(美元) | 说明与风险因素 |
|---|---|---|
| 官方申请费 | 2.2万(510(k))至 480万(PMA)不等 | 小企业可申请大幅减免。费用每年调整,必须按财年预算。 |
| 第三方服务费 | 最大的弹性变量,决定项目成败。 | |
| 1. 法规咨询与策略 | 3万 - 20万+ | 经验丰富的顾问可避免方向性错误,价值最高。 |
| 2. 技术文档编写 | 5万(510(k))至数百万(NDA) | 取决于产品复杂度和所需非临床/临床数据的规模。 |
| 3. 合规测试费 | 10万 - 数亿 | 最大风险点。生物相容性、性能、灭菌、稳定性测试。药品临床III期费用极高。 |
| 4. 质量体系构建与审计 | 10万 - 50万+ | 建立符合QSR 820或cGMP的体系,及模拟审计。 |
| 隐性风险成本 | (难以估量,必须预留) | |
| 5. FDA检查整改与响应 | 5万 - 50万+ | 应对483表或警告函,涉及顾问、整改、后续提交。 |
| 6. 市场准入延迟损失 | 月度计算,可能巨大 | 因申请被拒或检查不合格导致的销售利润损失。 |
四、专家谏言:构建以质量为核心的长期主义策略
迈克尔·陈博士为中国企业提出三条核心建议:
第一,质量体系先行,而非产品先行。 在启动昂贵的检测与临床试验前,先投资建设经得起考验的全球化质量体系。
第二,善用“预提交”等沟通机制。 通过Q-Submission等程序,在关键节点前获得FDA的反馈,降低后期被拒风险。
第三,选择“战友型”合作伙伴。 选择在美有丰富成功申报经验,并能提供全程合规支持的CRO或咨询机构,而非单纯的服务外包商。
面对FDA日益严峻的全球化监管,中国企业的竞争优势正从“成本与效率”向“质量与合规”迁移。唯有将FDA合规内化为企业的核心能力,方能在这场以科学和规则为尺度的竞争中行稳致远。
热门文章
-
迈希泽-阻火圈|防火包|防火板|柔性防火密封胶|膨胀型防火封堵件|EAD 350454-00-1104
2026年3月2日
-
欧盟新版机械法规 (EU) 2023/1230 全解
2026年2月26日
-
预制房屋出口认证办理清单
2026年2月25日
-
ETA|欧盟ETA认证
2026年2月24日
-
迈希泽|车辆限速装置 SLD出海EMARK认证 ECE R89认证
2026年2月24日
-
迈希泽|内饰阻燃材料ECE R118 Emark认证
2026年2月24日
-
ETA认证|玻璃纤维网格布ETA
2026年2月24日
-
迈希泽ETA认证服务
2026年2月23日
-
迈希泽ETA认证服务
2026年2月23日
-
E-Mark-UN/ECE R103 法规
2026年2月6日
 获取更多资讯
获取更多资讯
