FDA合规路径与成本全解析:不同产品如何高效通过美国市场准入审查
FDA合规路径与成本全解析:不同产品如何高效通过美国市场准入审查
在全球医疗健康与食品领域,进入美国市场都绕不开一道关键门槛——美国食品药品监督管理局的监管要求。与欧盟CE标志的“符合性声明”模式不同,FDA建立了一套基于产品风险、科学证据和持续监督的多元化准入体系。企业面对的核心挑战不仅是“需要多少钱”,更是“我的产品究竟走哪条路”。本文将系统梳理FDA针对不同产品的监管逻辑、决策路径与资源投入,为企业提供清晰的导航。
一、核心认知:FDA是准入监督体系,而非单一“证书”
必须首先明确,FDA不颁发覆盖全公司的“质量体系认证”,也不提供“产品合格证书”。企业获得的通常是针对具体产品的“许可”、“批准”或“备案号”,其核心是FDA对申报资料科学性与合规性的审评通过。
FDA的监管逻辑严谨且差异化,整个决策路径可以概括为以下流程图。它清晰地揭示了从产品定义到最终合规状态的完整逻辑链条,是企业制定策略的起点:
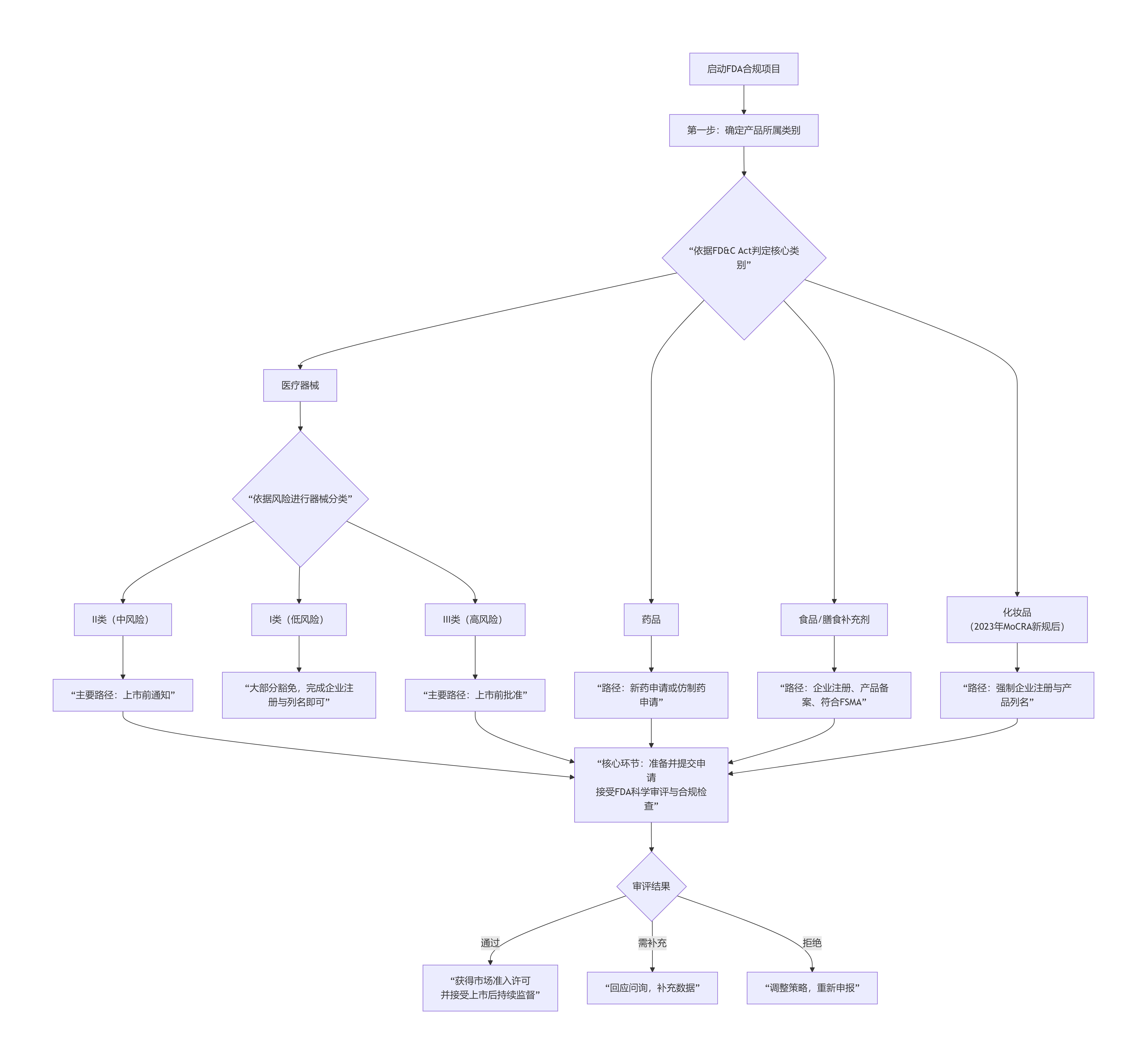
如图所示,选择正确的路径是控制时间与成本的第一关键。路径错误将导致申请被拒,前期投入尽数浪费。
二、分步详解:主要类别产品的合规核心与差异
下表以医疗器械、食品、药品和化妆品为例,详细拆解其核心的FDA合规路径、关键任务及负责的FDA审评中心。
| 产品类别 | 主要监管路径与法律依据 | 核心任务与要求 | 负责的FDA中心 | 特点与难点 |
|---|---|---|---|---|
| 医疗器械 | 510(k)(上市前通知):证明与已合法上市产品“实质等同”。 PMA(上市前批准):提供有效的科学证据(常含临床试验)。 De Novo:为新型中低风险器械建立分类。 | 1. 完成产品分类(I, II, III类)。 2. 建立并运行符合QSR 820的质量体系。 3. 准备详尽的技术文档。 4. 提交申请,应对问询。 5. 完成企业注册与产品列名。 | CDRH (器械与放射健康中心) | 路径明确,风险分级管理。II类器械的“实质等同”对比证据是510(k)的关键。 |
| 食品/膳食补充剂 | 企业注册:依据《生物反恐法》强制注册。 产品备案:针对酸化食品等。 符合FSMA:建立基于风险的预防控制体系。 | 1. 每偶数年更新企业注册。 2. 确保标签符合营养成分标签法规。 3. 建立食品安全计划,应对检查。 4. 膳食补充剂需遵守GMP并确保成分安全。 | CFSAN (食品安全与应用营养中心) | 强调过程监管与预防。对于进口食品,FDA主要通过边境抽查和委托第三方审核进行监督。 |
| 药品/生物制品 | NDA(新药申请)/BLA(生物制品许可申请):需经过严格的临床试验(IND阶段)。 ANDA(仿制药申请):证明与参照药生物等效。 | 1. 临床前研究。 2. 提交IND,进行I-III期临床试验。 3. 提交NDA/BLA,包含全部数据。 4. 建立并维持cGMP合规生产体系。 | CDER/CBER (药物/生物制品评价与研究中心) | 周期最长(常超10年),成本最高,科学审评最严格。专利与市场独占期是核心商业考量。 |
| 化妆品(新规后) | 强制企业注册与产品列名:依据2022年《化妆品现代化管理法案》。 安全证明:需有充分证据支持产品安全性。 | 1. 完成设施注册与产品列名。 2. 准备并保存产品安全证据档案。 3. 标注不良反应联系电话。 4. 符合香精致敏原等标签要求。 | CFSAN | 从自愿备案进入强制监管时代。企业需为新规的全面实施做好准备,安全证明是全新挑战。 |
三、费用深度剖析:官方费用与第三方服务成本
FDA相关费用主要由FDA官方收取的审评费和企业承担的第三方服务费构成。以下为基于当前财年(通常每年10月更新)的费用概览。
| 费用大项 | 具体分项与说明 | 市场参考价格范围(美元) | 主要影响因素与备注 |
|---|---|---|---|
| FDA官方申请费 | 510(k)提交费:标准企业提交510(k)申请的费用。 | 约22,000美元 | 费用每年调整。小型企业(符合收入标准)可享受大幅减免(约6,600美元)。 |
| PMA申请费:标准企业提交PMA申请的费用。 | 约48万美元 | 小型企业减免后费用约为12万美元。此仅为首次申请费,不含后续补充。 | |
| 药品NDA/BLA申请费 | 超过300万美元 | 根据PDUFA法案设定,费用极高,且每年调整。同样有小企业减免政策。 | |
| 企业注册与列名费 | 免费(医疗器械、食品) | 注册行为本身不收费,但化妆品新规下的注册未来可能涉及费用。 | |
| 第三方专业服务费 | 法规咨询与战略规划 | 2万 - 15万美元+ | 产品复杂程度、目标路径、顾问机构经验。明确的战略能避免后续巨大浪费。 |
| (占比最大,弹性最大) | 技术文档/申报资料编写 | 510(k): 3万 - 15万美元 PMA: 25万 - 150万美元+ NDA: 数百万美元起 | 取决于非临床与临床数据的规模、文献检索与分析的复杂度。是科学价值的体现。 |
| 合规测试费 | 5万 - 200万美元+ | 最大变量。含生物相容性、性能、灭菌、软件验证、稳定性等。药品的临床III期试验费用常达数亿。 | |
| 质量管理体系建立与审计 | 5万 - 50万美元+ | 建立符合QSR 820或cGMP的体系,包括文件、人员培训、内审。FDA现场检查前的模拟审计至关重要。 |
情景化费用估算
I类医疗器械(如普通压舌板):以企业注册和体系合规为主,总成本可控制在 3万 - 8万美元。
II类医疗器械(如普通监护仪,走510(k)):总成本通常在 15万 - 50万美元 之间,其中测试和文档编写是主要部分。
III类高风险植入器械(如心脏瓣膜,走PMA):仅申请准备阶段就可能花费 150万 - 500万美元,若需全新临床试验,总成本可轻松超过 1亿美元。
普通食品出口:以注册和合规为主,成本较低,主要在 1万 - 5万美元(不含硬件改造)。
四、关键策略建议:规划您的FDA合规之路
“分类先行”与“路径锁定”:在产品研发的最早期,投入资源与法规专家一同明确产品分类和预期路径。这是整个项目成本与周期的“定盘星”。
善用“小企业资质”与“预提交会议”:积极申请官方费用减免。通过FDA的预提交会议,就关键技术或法规问题获得官方反馈,能显著降低后期申报被拒的风险。
实施“质量源于设计”:将FDA的法规要求(如设计控制、风险分析、工艺验证)深度融入研发流程,而非事后补课。这是最有效的成本控制与质量控制手段。
将第三方服务视为战略投资:选择在特定产品领域有成功经验的法规顾问、测试实验室和临床研究组织。他们的专业性能帮助您少走弯路,看似高昂的咨询费往往能节省巨额的试错成本和时间成本。
建立长期合规视野:FDA合规不是“一次性项目”。获得准入后,需持续维护质量体系、进行不良反应监测、报告变更并接受定期检查。预算和团队建设需具备持续性。
总结而言,FDA准入的投入,本质上是为产品在美国这个全球最严格市场之一的安全性和有效性所提供的“科学背书”和“合规保障”的总成本。 这是一项高风险、高回报的战略性投资。通过精准的路径规划、科学的证据生成和专业的资源整合,企业不仅能成功打开市场,更能借此构建起超越同行的核心竞争力。
热门文章
-
EAC认证怎么办理2026流程来了
2026年1月19日
-
欧盟EAC认证全流程权威解读:您的产品进入欧亚市场的必由之路
2026年1月12日
-
EAC认证费用深度解构:为何没有“一口价”?企业预算精准规划指南
2026年1月12日
-
EAC认证需要怎么做
2025年12月25日
-
FDA合规路径与成本全解析:不同产品如何高效通过美国市场准入审查
2025年12月24日
-
EAC rohs认证
2025年12月24日
-
CE认证深入解析:中国企业通往欧洲市场的合规必修课与战略指南
2025年12月19日
-
CE认证到底管哪些产品?你的货出口欧洲必须办吗?
2025年12月19日
-
CE认证办理全流程与费用深度解析:从零到通关的完整指南
2025年12月19日
-
EAC rohs认证
2025年12月11日

 获取更多资讯
获取更多资讯
